Atom – kimyəvi elementin xassələrini özündə saxlayan ən kiçik zərrəcik.[1] Hər bir elementin atomu quruluşuna, xassələrinə görə fərqlənir və elementin kimyəvi simvolu ilə işarə olunur (məsələn, hidrogen atomu – H, oksigen atomu – O, mis atomu – Cu və s.). Atom həm sərbəst, həm də rabitəli hallarda mövcuddur. Qaz, maye və bərk cisimlərin xassələri onların tərkibindəki atomların xassələrindən asılıdır. Atomun bütün fiziki və kimyəvi xassələri onun quruluşu ilə müəyyənləşir və kvant qanunlarına tabedir.[2]

Atomlar ifrat dərəcədə kiçikdir, onların ölçüsü, adətən 100 pikometr tərtibində olur. İnsan saçının eni təxminən bir milyon karbon atomuna bərabərdir. Atomlar görünən işığın dalğa uzunluğundan minlərlə dəfə kiçikdir və buna görə də insanlar adi mikroskopla atomları görə bilmirlər.[3] Atom səviyyəsində kvant effektləri meydana çıxdığı üçün klassik fizikanın qanunları keçərli olmur.[4]
Atom nüvə və elektronlardan ibarətdir. Atomun kütləsinin 99, 9%-dən çoxu nüvədə toplanmışdır. Atomun nüvəsi proton və neytronlardan ibarətdir. Protonların elektrik yükü müsbət, neytronlarınkı isə sıfırdır və buna görə də nüvə müsbət yükə malikdir.[5] Elektronlar isə mənfi yüklüdür və bu əks yük sayəsində nüvə ilə rabitə yaradırlar. Müasir təsəvvürlərə görə elektronlar nüvə ətrafında sürətlə hərəkət edərək elektron buludu əmələ gətirir.[6] Proton və elektronların sayı bərabər olduğu üçün atom elektrik cəhətdən neytraldır. Atom elektron verdikdə müsbət yüklü iona (kationa),[7] elektron aldıqda isə mənfi yüklü iona (aniona) çevrilir.[8]
Atomun elektron və protonları elektromaqnit, nüvədəki proton və neytronlar isə nüvə qüvvəsi ilə cəzb olunur. Bu qüvvə adətən protonları bir-birindən itələyən elektromaqnit qüvvəsindən daha güclü olur. Bəzi hallarda itələyici elektromaqnit qüvvəsi nüvə qüvvəsini üstələyir. Bu zaman nüvə parçalanır və müxtəlif elementlər əmələ gəlir. Bu hadisə radioaktiv parçalanma adlanır.[9]
Atomlar öz aralarında kimyəvi rabitə quraraq molekulları əmələ gətirir. Təbiətdə müşahidə olunan əksər kimyəvi dəyişikliklər atomların rabitə yaratma qabiliyyətindən asılıdır.[10][11] Belə dəyişikliklər kimya elmində öyrənilir.
Maddənin kiçik bölünməz zərrəciklərdən ibarət olması bir çox antik mədəniyyətlərdə ortaya çıxan qədim fikirdir.[12] "Dünya nədən təşkil olunmuşdur?" sualına ən dərin və ardıcıl cavabı isə ilk dəfə Levkipp və onun dahi şagirdi Demokrit vermiş və onların ardıcılları olan yunan filosofu Epikür və Roma filosof-şairi Lukretsi Kar tərəfindən inkişaf etdirilmişdir. Bu təlimə görə dünyadakı bütün şeylər olduqca kiçik, bölünməz, dəyişməz, əbədi mövcud olan zərrəciklərdən təşkil olunmuşlar. Həmin zərrəcikləri Demokrit atom adlandırmışdır.[13] Atom sözü qədim yunan dilindəki atomosdan törəyib və "bölünməz" deməkdir.[14] Qədimdə "atom" ideyası əsasən fəlsəfi xarakter daşıyırdı. Müasir atom nəzəriyyəsi həmin dövrün köhnə anlayışlarına əsaslanmır. 19-cu əsrin əvvəlində ingilis alimi Con Dalton maddənin həqiqətən də diskret vahidlərdən ibarət olduğunu sübuta yetirmiş və həmin vahidləri adlandırmaq üçün atom sözündən istifadə etmişdir.[15]

1800-cü illərin əvvəlində C. Dalton atom hipotezini rəhbər tutaraq özünün və başqa alimlərin əldə etdiyi təcrübi faktlara əsaslanmaqla həndəsi nisbətlər qanununu irəli sürmüşdür. Bu qanuna görə əgər iki element bir-birilə bir neçə birləşmə əmələ gətirirsə, həmin elementlərdən birinin eyni miqdarına digərinin elə miqdarı düşür ki, onların bir-birinə nisbəti sadə tam ədədlərin nisbəti kimi olur.[16] Məsələn, azot oksidlərində belə olur: diazot-monooksid 63,3% azot, 36,7% oksigendən; azot-monooksid 44,05% azot, 55,95% oksigendən; azot-dioksid isə 29,5% azot, 70,5% oksigendən ibarətdir. Deməli, diazot-monooksiddə hər 140 q azot üçün 80 q oksigen, azot-monooksiddə hər 140 q azot üçün 160 q oksigen, azot-dioksiddə isə hər 140 q azot üçün 320 q oksigen düşür. Beləliklə, 80, 160 və 320 1:2:4 nisbətini təşkil edir. Bu oksidlər üçün müvafiq formullar N2 O, NO, NO2 şəklində olur.[17]
Dalton atom kütlə vahidi kimi hidrogenin atom kütləsini qəbul edərək bəzi kimyəvi elementlərin nisbi atom kütlələrinin ilk cədvəlini vermiş, atomları işarə etmək üçün ilk dəfə içərisi müxtəlif formada doldurulmuş dairə simvollarını təklif etmişdir. O kimyəvi atomistikanın müddəalarını Kimya fəlsəfəsinin yeni sistemi əsərində ifadə etmişdir.[18]
1897-ci ildə Cozef Tomson katod şüalarının elektrik və maqnit sahəsində meylinə əsasən onların mənfi yüklü zərrəciklərdən ibarət olduğunu kəşf etmişdir.[19] O, həmin mənfi yüklü hissəciyi əvvəlcə korpuskul adlandırmış, lakin elektrik enerjisinin daşıyıcısı olduğu məlum olduqdan sonra Corc Stoni ona elektron adını vermişdir.[20] Həmçinin, Tomson elektronların fotoelektrik və radioaktiv materiallardan ayrılan zərrəciklərlə eyni olduğunu göstərmişdir.[21] O elektrik cərəyanını elektronların bir atomdan digərinə keçməsi ilə, cərəyanın olmamasını isə elektronların atomda bağlı halda qalması ilə izah edirdi. Bu da öz növbəsində atomların alimlərin düşündüyü kimi bölünməz olmadığını göstərirdi. Atom eyni sayda müsbət və mənfi yüklərdən ibarət idi və beləliklə də elektrik cəhətdən neytrallığını qoruyurdu. Tomsonun izahına görə ionlar elektron çoxluğuna və ya azlığına malik olan atomlar olmalıdır.[22]

Atomdakı elektronlar məntiqi olaraq mütənasib miqdarda müsbət yüklə tarazlaşmalı idi, lakin Tomson həmin müsbət yükün haradan qaynaqlandığını bilmirdi, ona görə də o müsbət yüklərin kürə formalı atomun hər yerində olduğunu irəli sürürdü. Bu mövcud sübutlara uyğun gələn riyazi cəhətdən ən sadə fərziyyə idi. Tomson buradan çıxış edərək elektrostatik qüvvələrin elektronları kürə boyunca az-çox bərabər paylayacağını təsəvvür edirdi. Tomson modeli gavalılı pudinq modeli kimi də məşhurlaşmışdır, ancaq nə Tomson, nə də onun məsləkdaşları bu analogiyadan istifadə etməmişdir.[23]
Atomun Tomson modeli bəzi hadisələri, məsələn, atomun ionlaşması, elektroliz, kimyəvi elementlərin dövri sistemi və s. izah etməyə imkan verdi. Lakin bu model elementlərin şüalanma spektrini, valentliyi, radioaktivliyi, elektromaqnit hadisələrini və s. izah edə bilmədi.[20]
1908–1913-cü illər arasında Ernest Rezerford və onun həmkarları Hans Geyger və Ernest Marsden nazik metal folqaları alfa-zərrəciklərlə bombardman edərək silsilə təcrübələr həyata keçirdilər.[24] Buradakı məqsəd α-zərrəciklərin necə səpildiyini yoxlamaq idi. Təcrübələrdən məntiqi olaraq gözlənilirdi ki, α-zərrəciklər atomla qarşılaşdıqda onların əksəriyyəti səpilməyə məruz qalmalıdır. Çünki Tomson modelinə əsasən, atomun bütün həcmi bərabər sıxlıqda paylanmış müsbət yüklü kütlədən ibarətdir. Lakin təcrübədən gözlənilməz hadisə müşahidə olundu: qızıl atomları üzərinə düşən α-zərrəciklərin əksəriyyəti istiqamətini dəyişmədən folqanı keçir, bəziləri müəyyən bucaq altında səpilir, çox nadir halda (hər 2000 zərrəcikdən biri) folqadan 180° əks edərək geri qayıdırdı.[25] Yalnız yüksək kütlə ilə sabitləşmiş bu cür yük konsentrasiyası α zərrəciklərini meylləndirən elektrik sahəsini meydana gətirə bilərdi.[26]
Beləliklə, bu təcrübədən alınan nəticələrə əsasən atomun Tomson modelinin doğru olmadığı müəyyənləşdirildi. Rezerforda görə, atom kütləsinin böyük hissəsi və müsbət yükü atomun bütün həcmində deyil, mərkəzində yerləşir. Elektronlarla müsbət yüklər arasında boşluq mövcuddur. Rezerford atomun müsbət yüklərinin cəmləşdiyi çox kiçik hissəsini atomun nüvəsi adlandırdı. Beləliklə, Rezerford modelinə görə atom aşağıdakı quruluşa malikdir:[27][28]
- Atomun demək olar ki, bütün kütləsi onun nüvəsində toplanmışdır və onun ölçüsü atomun ölçüsü ilə müqayisədə çox kiçikdir. Sonralar müəyyən olundu ki, nüvənin diametri ≈10−15 m-dir.
- Atom nüvəsi müsbət yükə (𝑞N) malik olub e elementar yükün elementin dövri sistemdəki Z sıra nömrəsi ilə hasilinə bərabərdir:
- Elektronlar nüvə ətrafında dairəvi orbitlər üzrə hərəkət edir. Neytral atomda elektronların sayı Z-ə bərabərdir. Bu model Günəş sisteminə bənzədiyindən ona atomun planetar modeli də deyilir.
Lakin bu model atomun davamlı mövcud olmasını izah etməkdə çətinliklə üzləşdi. Klassik mexankiaya görə çevrə üzrə hərəkət təcilli hərəkət olduğundan atomdakı elektronlar fasiləsiz olaraq fırlanma tezliyinə bərabər tezlikdə elektromaqnit dalğaları şüalandırmalıdır. Bunun nəticəsində elektronun kinetik enerjisi sürətlə azalmalı və get-gedə aşağı orbitlərə keçməli və nəhayət, nüvə üzərinə düşməlidir – atomun varlığına son qoyulmalıdır. Əslində isə atom sistemi davamlı olaraq mövcuddur.

Rezerfordun izah edə bilmədiyi bu çətin vəziyyətdən çıxış yolunu 1913-cü ildə danimarkalı fizik Nils Bor göstərdi. Bor atomun dayanıqlığını və onun bir çox xassələrini elektronların atomda hərəkətinə bəzi məhdudiyyətlər qoymaqla izah etdi. O, aşağıdakı postulatlar (isbatsız qəbul olunmuş müddəalar) əsasında atomun planetar modelinin çətinliklərini kvant təsəvvürləri əsasında aradan qaldırdı:[29]
Birinci postulat: atomlar yalnız hər birinə müəyyən enerji uyğun gələn xüsusi stasionar hallarda və ya kvant hallarında ola bilər. Stasionar halda atom elektromaqnit dalğaları şüalandırmır və udmur.
İkinci postulat: atom böyük enerjili stasionar haldan kiçik enerjili stasionar hala keçdikdə şüalanma baş verir. Bu zaman elektron uzaq orbitdən nüvəyə yaxın orbitə keçir. Əksinə, atom enerji udduqda kiçik enerjili stasionar haldan böyük enerjili stasionar hala keçir. Bu zaman elektron nüvəyə yaxın orbitdən uzaq orbitə keçir.
Hələ 1815-ci ildə Uilyam Prut bir çox elementlərin atom çəkisinin hidrogenin atom çəkisinin tam mislinə bərabər olduğunu müşahidə etmişdir. 1898-ci ildə C. Tomson elektronun yükünü hesablayıb, birinci dəfə, e=3·10−10 müt.el.yük vahidi nəticəsini almışdır. Sonra Tomson elektronun yükünü təyin etmək üçün daha dəqiq qurğu düzəldib (1899) ultrabənövşəyi şüalarla ionlaşma aparmışdır. Bu təcrübədən o, e=6,8·10−10 müt.el.yük vahidi nəticəsini almışdır.[30] 1913-cü ildə Henri Mozli rentgen şüalarının atomdan yayılma tezliyinin atom nömrəsinin və hidrogenin nüvə yükünün riyazi funksiyası olduğunu kəşf etmişdir.[31][32] 1919-cu ildə Rezerford azot qazını α-zərrəciklərlə bombardman etmiş və α-zərrəciklərin azot nüvəsinin hidrogen atomuna bənzəyən müsbət yüklü zərrəciklərdən meydana gəldiyini göstərirdi.[33]
Bu müşahidələrlə Rezerford hidrogen nüvəsinin elektrondan və ona əks olan vahid müsbət zərrəcikdən ibarət olması qənaətinə gəldi.[34] O, 1920-ci ildə bu zərrəciyi proton adlandırdı.[35] Atomdakı proton sayının (Rezerford bunu "atom nömrəsi" adlandırırdı) elementin dövri cədvəldəki sıra nömrəsinə bərabər olduğu aşkar edildi və beləliklə, bu sadə və aydın üsul bir elementi digərindən ayırmağa imkan verdi.[36][37] Rezerford elementlərin atom çəkisinin onun proton sayından yüksək olmasını izah etmək üçün elektrik yükü olmayan və kütləsi protonun kütləsinə bərabər olan naməlum zərrəciklərin mövcud olmasını fərz edirdi.
Neytronun kəşfinin köklərini alman fizikləri Herbert Beker və Volter Botenin tədqiqatlarına qədər izləmək mümkündür. 1930-cu ildə V. Bote və H. Beker müşahidə etmişlər ki, berilliumu α-zərrəciklərlə bombardıman etdikdə sərt neytral şüalar yaranır. Onlar bu şüanı g-şüa ilə eyniləşdirərək, nüfuzetmə qabiliyyətinə görə onun enerjisini hesablamış və 5MeV almışlar.
1931-ci ildə fransız alimləri İren (S.-K. Mariyanın qızı) və Frederik Jolio-Kürilər (ər-arvad) "berillium şüaları"nın xassələrinin tədqiqini davam etdirmiş və onların parafindən (hidrogenlə zəngin maddə) proton çıxardıqlarını müşahidə etmişlər. Yaranan protonun izinin uzunluğuna əsasən göstərmişlər ki, g-şüa hesab etdikləri "berillium şüaları"nın bu hadisəni törətmələri üçün onların enerjisi ~ 50MeV olmalıdır. Bu nəticə Bote-Beker nəticələrinə ziddir. 1932-ci ildə ingilis alimi Ceyms Çedvik "berillium şüaları"nı başqa maddələrdən də keçirərək, təkcə protonun deyil, eləcə də başqa nüvələrin (litium, berillium, bor, karbon, azot və s.) də təpməsini müşahidə etmişdir. Göstərmişdir ki, məsələn, təpməazotu təcrübəsində "berillium şüaları" özlərini ~ 100MeV (50MeV yoх!) enerjili g-kvantlar kimi aparmışlar. Aşkar ziddiyyət: yaratdığı məhsullardan hansının (protonun, yoxsa başqa bir nüvənin, məsələn, azotun) qeydə alınmasından asılı olaraq, eyni bir g-kvanta müxtəlif enerjilər şamil edilir! Çoxlu miqdarda təcrübi materialların təhlilinə əsasən Çedvik belə nəticəyə gəlir ki, "berillium şüası" g-kvantlar olmayıb, ağır neytral zərrəciklərdir. O, həmin zərrəciyə kütlə şamil edərək, dərhal təpməproton və təpmə-azot reaksiyaları üçün enerji və impulsun saxlanması qanunlarına (qeyri-relyativistik halda) və təcrübələrdə proton və nüvələr üçün alınmış maksimal sürətlərə əsasən tapır ki, berilliumun buraxdığı neytral zərrəciyin kütləsi protonun kütləsindən təqribən 1,5 dəfə böyükdür. Bax beləcə, düzgün ölçmələr və kinematik hesablamalarla kütləsi təqribən protonun kütləsi qədər olan yeni, neytral zərrəcik kəşf olundu (C. Çedvik, 1932). Həmin zərrəcik neytron adlandırıldı.[38]

1924-cü ildə Lui de Broyl materiyanın dalğa xarakteri – bütün zərrəciklərin korpsukul-dalğa dualizminə dair radikal fərziyyəni irəli sürmüşdür.[39] De Broyl ideyasının məntiqi davamı olaraq fizik Verner Heyzenberq Maks Born və Paskual Yordanla birlikdə matris mexanikasının (1925), Ervin Şrödinger isə dalğa mexanikasının (1926) əsasını qoymuşdur.[40] Şrödingerin dalğa tənliyinə görə elektronlar fəzadakı maddi nöqtə yox, üçölçülü dalğa kimi təsvir olunur.[41] Zərrəcik özündə həm də dalğa xassəsini birləşdirdiyinə görə onun müəyyən andakı yerini və impulsunu riyazi cəhətdən dəqiqləşdirmək olmur. Bu Heyzenberqin 1927-ci ildə irəli sürdüyü qeyri-müəyyənlik prinsipidir.[42] Qeyri-müəyyənlik prinsipi klassik fizika qanunlarının mikroaləmə tətbiq olunma məhdudiyyətini göstərir.
Beləliklə, atomun Bor modelindən fərqli olaraq Şrödinger modelinə görə nüvə ətrafındakı elektronlar özünü dalğa ("bulud") kimi aparır.[43] Bor modelindəki dairəvi orbitlərin əksinə olaraq bu modeldə atom orbitalları sferik, hantelvari, lələkvari formaya malik olur.[44]
1930-cu illərin əvvəlində atomun proton, neytron və elektron adlı üç təməl zərrəcikdən ibarət olduğu düşünülürdü. Lakin çox keçmədən başqa zərrəciklər də kəşf edildi. Neytronun parçalanması neytrinonun proqnozlaşdırılmasına imkan verdi. Daha sonra kosmik şüalarda ağır elektrona bənzəyən müon və nüvədə nuklonlar arasında yapışqan rolunu oynayan pion zərrəcikləri kəşf edildi. Yeni zərrəciklərin alınması üçün isə zərrəcikləri yüksək sürətlə toqquşduran sürətləndiricilər yaradıldı. Hazırda yüzlərlə subatom zərrəciyin olması məlumdur.
Nüvənin yükü atomun əsas xarakteristikasıdır və onun müəyyən elementə məxsusluğunu şərtləndirir. Nüvədəki protonların sayı kimyəvi elementin dövri sistemindəki sıra nömrəsinə (Z) bərabərdir. Ona görə də ixtiyari atomun nüvəsinin yükü kimyəvi elementin sıra nömrəsinin elementar yükə hasilinə bərabərdir:[45]
Atomun kütləsi, əsasən, nüvəsinin kütləsi ilə təyin olunur və nüvədəki proton və neytronların ümumi sayını göstərən A kütlə ədədi ilə mütənasibdir. Elektronun kütləsi (≈0,91·10–27q) təxminən 1840 dəfə neytron və ya protonun kütləsindən (≈1,67·10–24 q) azdır, ona görə də atomda elektronların ümumi kütləsi nüvənin kütləsindən bir neçə min dəfə kiçikdir.[46]
Eyni bir elementin atomları müxtəlif kütlə ədədinə malik ola bilər (protonların sayı sabit, neytronların sayı isə dəyişən); belə atomlar izotop adlanır.[47] Nüvə kütlələri arasındakı fərq həmin elementin izotoplarının kimyəvi və fiziki xassələrinə, demək olar ki, təsir etmir. Ən böyük fərq (izotop effektləri) adi yüngül hidrogen (protium, A=1), deyterium (A=2) və tritium (A=3) kütlələri arasındakı böyük fərqə görə hidrogenin izotoplarında müşahidə edilir.[48]
Atom kütlələrinin ən dəqiq qiyməti kütlə spektroskopiyası üsulları ilə təyin olunur.[49] Atomun kütləsi nüvənin və bütün elektronların kütlələri cəmindən kütlə defekti qədər azdır; burada E – atomun rabitə enerjisi, c isə işığın sürətidir.[50] Ağır atomlar üçün elektron kütləsi tərtibində, yüngül atomlar üçün isə olduqca cüzi – elektron kütləsinin ~10 – 4 hissəsi qədərdir.
Atomlar dəqiq xarici sərhədlərə malik deyil, buna görə də onların ölçüsü kimyəvi rabitə yaratmış eyni atomların nüvələri arasındakı məsafənin yarısına (kovalent radius) əsasən şərti olaraq müəyyən edilir. Bu isə adətən nüvə ilə ən kənar təbəqədəki elektronlar arasındakı orta məsafəyə uyğundur.[51] Bununla belə, bu şəkildə müəyyən edilmiş ölçülər kimyə rabitənin növündən, qonşu atomların sayından və onların spinindən asılıdır.
Radioaktivlik dedikdə kimyəvi elementin qeyri-stabil izotopunun elementar zərrəciklər və ya nüvə şüalandırmaqla digər elementin izotopuna spontan (öz-özünə) çevrilməsi başa düşülür.
Radioaktiv parçalanmanın üç əsas forması vardır:[52]
- Alfa-parçalanma: nüvə alfa zərrəciyini – iki proton və iki neytrona malik helium nüvəsini buraxan zaman baş verir. Alfa-çevrilmə nəticəsində nüvənin yük ədədi iki, kütlə ədədi dörd vahid azalır.
- Beta-parçalanma: zəif qarşılıqlı təsirlər nəticəsində baş verir və birinci halda neytronun proton, elektron və antineytrinoya, ikinci halda isə proton, pozitron və neytrinoya parçalanması ilə nəticələnir. Elektron və pozitron betα-zərrəciklər adlanır. Birinci çevrilmə nəticəsində yük ədədi bir vahid artır, ikincidə isə bir vahid azalır. Hər iki halda kütlə ədədi sabit qalır.
- Qamma-parçalanma: nüvənin enerji səviyyəsinin daha aşağı hala keçməsi səbəbindən baş verir və nəticədə elektromaqnit şüalanması yaranır. Qamma-şüalanma adətən alfa- və ya betα-zərrəciklərin buraxılmasından sonra baş verir. Beləliklə, qamma-parçalanma, adətən alfa- və ya beta-parçalanmanın ardınca gedir.
Radioaktivlik statistik xarakterə malikdir. Zaman keçdikcə radioaktiv nüvələrin sayı eksponensial qanunla azalır. Radioaktiv nüvələrin yaşama müddəti yarımparçalanma dövrü (yarımçevrilmə dövrü, T1/2) və ya orta yaşama müddəti (τ≈1,4 T1/2) ilə xarakterizə olunur. Bu müddətdə radioaktiv nüvələrin yarısı radioaktiv çevrilməyə uğrayır. Əksər hallarda radioaktiv çevrilmə nəticəsində alınmış nüvə radioaktiv olur və stabil nüvə alınanadək bir neçə radioaktiv çevrilmə baş verir.
Elementar zərrəciklər spin adlı daxili kvant-mexaniki xassəyə malikdir. Bu kütlə mərkəzi ətrafında fırlanan cismin impuls momentinə bənzəyir, lakin buna baxmayaraq, həmin zərrəciklərin nöqtəvi olması məlumdur və onlar fırlanma oxuna malik deyillər, buna görə də onların fırlandığını söyləmək doğru deyil. Buna rəğmən tarixən elektronun öz oxu ətrafında fırlanırmış kimi düşünülməsi praktik baxımdan olduqca faydalı olmuşdur.[53]
Spin gətirilmiş Plank sabiti () vahidləri ilə ölçülür və bütün elektron, proton və neytronların spini ½ və ya — ½ olur. Atomda nüvə ətrafında hərəkət edən elektronlar öz spinindən əlavə orbital impuls momentinə, nüvənin özü isə nüvə spininə görə impuls momentinə malik olur.[54]
Atomun yaratdığı maqnit sahəsi—onun maqnit momenti—fırlanan yüklü cismin klassik olaraq maqnit sahəsi yaratdığı kimi, impuls momentinin həmin müxtəlif formaları ilə müəyyən edilir, lakin ən böyük pay elektronun spinindən gəlir. Pauli prinsipinə görə eyni kvant halında olan iki elektron ola bilməz. Hər bir orbitalda maksimum iki əks spinli elektron yerləşə bilir. Beləliklə, bu spinlər bir-birini ləğv edərək elektronlarının sayı cüt olan bəzi atomlarda ümumi maqnit dipol momentini sıfıra endirir.[55]
Dəmir, kobalt və nikel kimi ferromaqnit elementlərdə tək sayda elektron cütləşməmiş elektrona və xalis ümumi maqnit momentinə səbəb olur. Qonşu atomların orbitalları üst-üstə düşür və cütləşməmiş elektronların spinləri bir-birinə uyğunlaşdıqda daha aşağı enerji vəziyyətinə nail olur, bu, mübadilə qarşılıqlı təsiri kimi tanınan kortəbii prosesdir. Ferromaqnit atomlarının maqnit momentləri düzüldükdə, material ölçülə bilən makroskopik sahə yarada bilər. Paramaqnit materiallarda maqnit sahəsi olmadıqda təsadüfi istiqamətlərdə düzülən maqnit momentləri olan atomlar var, lakin ayrı-ayrı atomların maqnit momentləri sahənin mövcudluğunda düzülür.[56][57] Atomun nüvəsi həm neytronların, həm də protonların cüt ədədlərinə malik olduqda spini olmayacaq, lakin tək sayda olan digər hallarda nüvənin spini ola bilər. Normal halda spini olan nüvələr istilik tarazlığına görə təsadüfi istiqamətlərdə düzülür, lakin müəyyən elementlər üçün (məsələn, ksenon-129) nüvə spin vəziyyətlərinin əhəmiyyətli bir hissəsini polyarlaşdırmaq mümkündür ki, onlar eyni istiqamətdə düzülərək hiperpolyarizasiya adlanan vəziyyətə çatsınlar. Bu maqnit rezonans tomoqrafiyada mühüm tətbiqlərə malikdir.[58][59]
Kvant mexanikasına görə atom sistemləri yalnız stasionar hallarda dayanıqlı ola bilər. Həmin hallarda atom sisteminin ala biləcəyi enerjilərin ardıcıllığı – enerji səviyyələri sistemin enerji spektrini təşkil edir.[60] Atom sisteminin enerjisinin dəyişməsi yalnız onun bir stasionaг haldan digər hala sıçrayışı (bir enerji səviyyəsindən digərinə keçidi) nəticəsində baş verir. Enerjinin saxlanması qanununa görə atom sistemi bir enerji səviyyəsindən digərinə keçdikdə enerjini udur və yaxud şüalandırır. Hər hansı aşağı enerji səviyyəsindən yuxarı səviyyələrə keçid zamanı sistemin enerjisi artır, yəni kvantlar udulur. İxtiyari yuxarı enerji səviyyəsindən aşağı səviyyələrə keçid nəticəsində sistemin enerjisi azalır, yəni kvantlar şüalanır.[61]

Yuxarı enerji səviyyələrindən aşağı səviyyələrə keçidlər çoxluğu şüalanma spektrini, aşağı səviyyələrdən yuxarı səviyyələrə keçidlər çoxluğu isə udulma spektrini əmələ gətirir. Enerji səviyyələri diskret və ya kəsilməz ola bilər. Bor münasibəti enerji səviyyələrinin həm diskret, həm də kəsilməz halları üçün doğrudur.[62] Diskret səviyyələr arasında baş verən keçidlər nəticəsində udulma və şüalanma spektrləri diskret olacaqdır. Diskret-kəsilməz və kəsilməz-kəsilməz enerji səviyyələri arasında baş verən şüalanma və udulma spektrləri isə bütöv olur. Sərbəst atomların spektri diskretdir, yəni müəyyən eni olan xətlərdən ibarətdir. İkiatomlu molekulların spektri də müəyyən zolaqlardan ibarət diskret xətlərdir. Belə spektrlər diskret zolaqlı spektrlər adlanır. Çoxatomlu molekulların spektri isə enli bütöv zolaqlardan ibarət olur.[63]
Bütöv enerji spektri qaz və ya plazmadan keçdikdə atomlar fotonların bir hissəsini udur və elektronların enerji səviyyəsinin dəyişməsinə səbəb olur. Öz atomlarına bağlı qalan həyəcanlanmış elektronlar təsadüfi istiqamətdə hərəkət edərək bu enerjini foton şəklində kortəbii buraxır və nəticədə daha aşağı enerji səviyyələrinə keçir. Beləliklə, atomlar özlərini enerji çıxışında bir sıra qaranlıq udma zolaqları meydana gətirən filtr kimi aparırlar. Atomun spektral xətlərinin intensivliyi və eninin spektroskopik ölçüləri maddənin kimyəvi tərkibini və fiziki xüsusiyyətlərini təyin etməyə imkan verir.[64]
Atom və molekulların enerji səviyyələri bir-birindən kəskin fərqlənir. Atomların enerji səviyyələri əsasən elektronların enerjisi ilə təyin olunur. Molekulda isə elektronların nüvələrə nisbətən hərəkətindən başqa atomların bir-birinə nəzərən rəqsi hərəkəti və molekulun fırlanma hərəkətləri mümkündür.[65]
Molekulda atomları bir-birinə bağlayan qüvvələrin cəmi kimyəvi rabitə adlanır.[66] Sərbəst atomun ən xaricdəki elektron örtüyü valent örtüyü, bu örtükdəki elektronlar isə valent elektronları adlanır. Kimyəvi rabitəni bir-birilə təmasda olan element atomlarının xarici elektron təbəqəsindəki valent elektronları əmələ gətirir. Valent elektronlarının sayı bir atomun digər atomlarla qurduğu rabitənin xarakterini müəyyən edir.[67]
Kimyəvi rabitələr əmələ gələrkən təsir edən qüvvələr, əsasən, elektrik təbiətlidir. Kimyəvi rabitələrin əmələ gəlməsi bir-biri ilə birləşən atomların elektron təbəqələrinin yenidən qurulması və fəzada nizamlanmış stereoquruluşların əmələ gəlməsi ilə nəticələnir.[68] Məlumdur ki, hər bir atom nüvədən və elektronlardan təşkil olunmuşdur. Bütün sistem müəyyən edilmiş enerjiyə malikdir. Bu enerji elektronların nüvə ilə qarşılıqlı təsirinin potensial və kinetik enerjisinin cəmindən ibarətdir. İstənilən sistemin enerji səviyyəsi nə qədər aşağı olarsa, o sistem daha stabil (sabit) və davamlı olar. Deyilənləri ümumiləşdirərək, belə bir nəticəyə gəlmək olar ki, iki atomdan sabit molekulun əmələ gəlməsi atomların bir-birinə yaxınlaşması və minimum enerjiyə çatması ilə əldə edilir.[69]

Atomlar temperatur və təzyiq kimi fiziki şərtlərdən asılı olaraq, maddənin müxtəlif hallarında müəyyən miqdarda mövcud ola bilərlər. Şərtlər dəyişdikdə maddə Boze-Eynşteyn kondensatı (BEK), bərk, maye, qaz, plazma arasında keçid edə bilir.[70] Eyni haldakı maddə müxtəlif allotropik şəkildəyişmələr (allotroplar) əmələ gətirə bilər. Buna misal olaraq qrafit və ya almaz kimi mövcud olan bərk karbonu, oksigenin allotropları olan dioksigen və ozonu göstərmək olar.[71]
Mütləq sıfıra yaxın temperaturda atomlar Boze-Eynşteyn kondensatı əmələ gətirə bilər, bu zaman adətən yalnız atom miqyasında müşahidə olunan kvant-mexaniki təsirlər makroskopik miqyasda aydın olur.[72][73] Həmin ifrat soyudulmuş atomlar yığını daha sonra vahid superatom kimi davranır və bu kvant effektlərinin əsaslı yoxlanılmasına şərait yaradır.[74] Boze-Eynşteyn kondensatları qara dəliklərə xas olan şərtləri simulyasiya etdiyindən həmin sahədəki araşdırmalarda da istifadə olunurlar. Həmçinin, kvant effektlərinin makroskopik səviyyədə müşahidə olunmasına görə kvant informasiyası kondensə olunmuş mühitdə toplana bilər. Bu da kvant kompüterlərinin inkişafına zəmin yaradır.[75]

Atomlar adi gözlə görünməyəcək qədər kiçik olsalar da skanlayıcı tunel mikroskopu (STM) kimi cihazlar bərk cisimlərin səthindəki atomların vizuallaşdırılmasına imkan verir. Mikroskop kvant tunelləmə hadisəsinə əsaslanır. STM iynə ilə səth arasındakı fiziki təsirləri nano səviyyədə ölçərək materialların üçölçülü görüntülərini əldə edən cihazdır.[76] STM ilə işləyərkən ucunda yalnız bir atom qalacaq qədər itilənmiş metal iynə səthə yaxınlaşdırılır. İynə səthə 0,3–0,4 nm yaxınlaşdıqda, elektronlar iynədən axmağa başlayır. İynənin ucu ilə səth arasındakı həmin cərəyan axını tunelləmə adlanır. Bu cərəyan həm də iynə ilə səth arasındakı məsafənin eksponensial funksiyasıdır. Cərəyanı sabit saxlamaq üçün iynənin ucu ilə bərk cismin səthi arasındakı məsafəyə daim nəzarət edilir.[77] Skanlama zamanı uc iki ölçü üzrə hərəkət edir, lakin səthdən olan məsafəni dəyişdirərək üç istiqamətdə də hərəkət etdirmək mümkündür. Beləliklə, skanlayıcı tunel mikroskopundan istifadə etməklə tədqiq edilən səthin elektron və atom quruluşuna dair istənilən görüntü alınır.[78]
Barion materiya müşahidə olunan kainatın ümumi enerji sıxlığının təxminən 4%-ni təşkil edir.[79] Süd yolu kimi qalaktikalarda zərrəciklər daha yüksək konsentrasiyaya malikdir və ulduzlararası mühitdə (UAM) maddənin sıxlığı 105 ilə 109 atom/m3 arasında dəyişir.[80] Günəşin lokal köpüyün içərisində olduğuna inanılır, ona görə də günəş qonşuluğunda sıxlıq cəmi 103 atom/m3 təşkil edir.[81] Ulduzlar UAM-da sıx buludlardan əmələ gəlir və ulduzların təkamül prosesləri UAM-ın hidrogen və heliumdan daha massiv elementlərlə davamlı şəkildə zənginləşməsi ilə nəticələnir.
Süd Yolunun barion materiyasının 95%-ə qədəri ulduzların içərisində cəmləşib, buradakı şərait atom materiyası üçün əlverişsizdir. Ümumi barion kütləsi qalaktikanın kütləsinin təxminən 10%-ni təşkil edir;[82] kütlənin qalan hissəsi naməlum qaranlıq materiyaya aiddir.[83] Ulduzların daxilindəki yüksək temperatur əksər "atomları" tam ionlaşdırır, yəni bütün elektronları nüvələrdən ayırır. Ulduz qalıqlarında—onların səth təbəqələri istisna olmaqla—böyük təzyiq elektron örtüklərini mümkünsüz edir.

Elektronların Kainatdakı Böyük Partlayışın ilkin mərhələlərindən bəri mövcud olması düşünülməkdədir. Nukleosintez reaksiyalarında atom nüvələri əmələ gəlmişdir. Təxminən üç dəqiqə ərzində Böyük Partlayış nukleosintezi Kainatdakı helium, litium və deyteriumun çoxunu və bəlkə də berilyum və borun bir hissəsini hasil etmişdir.[84]
Atomların hər yerdə olması və stabilliyi onların rabitə enerjisindən asılıdır ki, bu da atomun nüvə və elektronlardan ibarət rabitələşməmiş sistemə nəzərən daha aşağı enerjiyə malik olduğunu göstərir. Temperatur ionlaşma potensialından çox yüksək olduqda maddə plazma — müsbət yüklü ionlardan (ehtimal ki, yalın nüvələrdən) və elektronlardan ibarət qaz şəklində mövcud olur. Temperatur ionlaşma potensialından aşağı düşdükdə atomlar statistik cəhətdən əlverişli hala gəlir. Böyük Partlayışdan 380.000 il sonra, genişlənən Kainatın elektronların nüvələrə bağlanmasına imkan verəcək qədər soyuduğu zaman, rekombinasiya adlanan dövrdən sonra atomlar (bağlı elektronlarla birlikdə) yüklü zərrəciklər üzərində hökmranlıq etməyə başladı.[85]
Heç bir karbon və ya daha ağır elementlər əmələ gətirməyən Böyük Partlayışdan bəri atom nüvələri helium elementinin daha çoxunu və (üçlü-alfa prosesi ilə) karbondan dəmirə qədər elementlərin ardıcıllığını yaratmaq üçün termonüvə reaksiyası vasitəsilə ulduzlarda birləşdi.[86]
Litium-6 kimi izotoplar, həmçinin bəzi berillium və bor kosmosda kosmik şüaların yayılması ilə əmələ gəlir.[87] Bu yüksək enerjili protonun atom nüvəsinə dəyməsi nəticəsində çoxlu sayda nuklonların atılmasına səbəb olur.
Dəmirdən daha ağır olan elementlər fövqəlnovalarda və toqquşan neytron ulduzlarında r-prosesi (sürətli neytron tutma), AGB ulduzlarında isə s-prosesi (yavaş neytron tutma) vasitəsilə əmələ gəlmişdir ki, bunların hər ikisi neytronların atom nüvələri tərəfindən tutulmasını nəzərdə tutur. Qurğuşun kimi elementlər əsasən daha ağır elementlərin radioaktiv parçalanması nəticəsində əmələ gəlmişdir.[88]
Yeri və onun sakinlərini təşkil edən atomların əksəriyyəti Günəş sistemini yaranmasında iştirak edən molekulyar buluddan çökən dumanlıqda indiki formada mövcud idi. Qalanları radioaktiv parçalanmanın nəticəsidir və onların nisbi nisbəti radiometrik tarixləmə ilə Yerin yaşını təyin etmək üçün istifadə edilə bilər.[89][90] Yer qabığındakı heliumun çox hissəsi (qaz quyularından gələn heliumun təxminən 99%-i, helium-3-ün daha az olması ilə göstərildiyi kimi) alfa parçalanmasının məhsuludur.[91]
Yer üzündə bir neçə iz atomları var ki, onlar başlanğıcda mövcud olmayıb (yəni "ilkin" deyil), nə də radioaktiv parçalanmanın nəticələridir. Karbon-14 atmosferdəki kosmik şüalar tərəfindən davamlı olaraq əmələ gəlir.[92] Yerdəki bəzi atomlar ya qəsdən, ya da nüvə reaktorlarının və ya partlayışların əlavə məhsulları kimi süni şəkildə yaradılmışdır.[93][94] Transuran elementlərindən — atom nömrələri 92-dən çox olanlardan — Yerdə təbii olaraq yalnız plutonium və neptunium mövcuddur.[95][96] Transuran elementlərinin radioaktiv ömrü Yerin indiki yaşından daha qısadır[97] və beləliklə, bu elementlərin müəyyən edilə bilən miqdarları, ehtimal ki, kosmik toz tərəfindən çökdürülmüş plutonium-244 izləri istisna olmaqla, çoxdan çürümüşdür.[98] Plutonium və neptuniumun təbii yataqları uran filizində neytronların tutulması nəticəsində əmələ gəlir.[99]
Yer təxminən 1,33 × 1050 atom ehtiva edir.[100] Arqon, neon və helium kimi az sayda sərbəst nəcib qaz atomlarının olmasına baxmayaraq, atmosferin 99%-i karbon qazı və iki atomlu oksigen və azot da daxil olmaqla molekullar şəklində bağlı haldadır. Yerin səthində atomların böyük əksəriyyəti su, duz, silikatlar və oksidlər daxil olmaqla müxtəlif birləşmələr yaratmışlar. Atomlar həmçinin kristallar, maye və ya bərk metallar daxil olmaqla diskret molekullardan ibarət olmayan materiallar yaratmaq üçün birləşə bilər. Bu atomar maddə molekulyar maddə ilə bağlı kiçik miqyaslı kəsilmiş nizamın xüsusi növü olmayan şəbəkəli quruluşlar əmələ gətirir.[101][102]
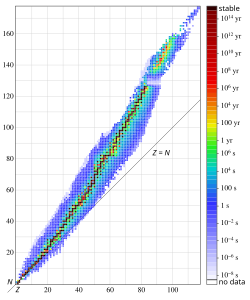
Atom nömrələri 82-dən (qurğuşun) yüksək olan bütün nuklidlərin radioaktiv olması məlumdur. Atom nömrəsi 92-dən çox olan heç bir nuklid (uran) Yer üzündə ilkin nuklid kimi mövcud deyil və daha ağır elementlər ümumiyyətlə daha qısa yarıömürə malikdir. Buna baxmayaraq, atom nömrələri 110-dan 114-ə qədər olan ifratağır elementlərin nisbətən uzunömürlü izotoplarını əhatə edən[103] "stabillik adası" mövcud ola bilər.[104] Adadakı ən stabil nuklidin yarımparçalanma dövrü ilə bağlı proqnozlar bir neçə dəqiqədən milyonlarla ilə qədərdir.[105] Hər halda, hər hansı stabilləşdirici təsirlər olmasaydı, artan Kulon itələməsi (bu getdikcə daha da qısalan yarımparçalanma dövrünə malik olan spontan parçalanma ilə nəticələnir) səbəbindən ifratağır elementlər (Z >104) var olmazdı.[106]
Materiyanın hər bir zərrəciyində əks elektrik yüklü müvafiq antimateriya zərrəciyi vardır. Beləliklə, pozitron müsbət yüklü antielektrondur və antiproton protonun mənfi yüklü ekvivalentidir. Materiya və müvafiq antimateriya zərrəcikləri qarşılaşdıqda, bir-birini məhv edirlər. Bu səbəbdən, materiyanın miqdarı ilə antimateriya zərrəcikləri arasındakı balanssızlıq ilə yanaşı, sonuncular kainatda nadirdir. Bu balanssızlığın ilk səbəbləri hələ tam başa düşülməmişdir, baxmayaraq ki, bariogenez nəzəriyyələri izahat verə bilər. Nəticədə təbiətdə heç bir antimateriya atomu kəşf edilməmişdir.[107][108] 1996-cı ildə Cenevrədəki CERN laboratoriyasında hidrogen atomunun antimateriyası (antihidrogen) sintez edilmişdir.[109][110]
Digər ekzotik atomlar proton, neytron və ya elektronlardan birini eyni yüklü digər zərrəciklərlə əvəz etməklə yaradılmışdır. Məsələn, elektronu müonik atom meydana gətirən daha massiv müon ilə əvəz etmək olar. Bu tip atomlar fizikanın fundamental proqnozlarını yoxlamaq üçün istifadə edilə bilər.[111][112][113]
- ↑ Melsen, Andrew Gerardus Van. From atomos to atom: the history of the concept atom. New York : Harper & Row. 1960.
- ↑ Sommerfeld, Arnold. Atomic structure and spectral lines. New York, Dutton. 1923.
- ↑ "Atomların En Yüksek Çözünürlüklü Görüntüsü | TÜBİTAK Bilim Genç". Bilim Genc (türk). İstifadə tarixi: 10 avqust 2025.
- ↑ Feynman, Richard Phillips; Leighton, Robert B.; Sands, Matthew. The Feynman Lectures on Physics (ingilis). Addison-Wesley. 1977. ISBN 978-0-201-02118-9.
- ↑ Məsimov, Eldar Əli oğlu. Maddənin quruluşu: Ali məktəb tələbələri üçün dərs vəsaiti (Təkrar nəşr). Bakı: Təfəkkür. 2011. səh. 4.
- ↑ Məsimov, Eldar Əli oğlu. Maddənin quruluşu: Ali məktəb tələbələri üçün dərs vəsaiti (Təkrar nəşr). Bakı: Təfəkkür. 2011. səh. 41.
- ↑ "Definition of CATION". www.merriam-webster.com (ingilis). 6 oktyabr 2021 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ "Definition of ANION". www.merriam-webster.com (ingilis). 3 avqust 2025. 6 oktyabr 2021 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ "Radioactivity : Weak Forces". 12 avqust 2021 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ Linus Pauling. Nature Of The Chemical Bond.
- ↑ "Chemical bonding | Definition, Types, & Examples | Britannica". www.britannica.com (ingilis). 26 iyul 2025. 9 iyul 2019 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ "Ancient atomism". Stanford Encyclopedia of Philosophy. 2 may 2019 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ Cəfərov, İsgəndər Həsən oğlu. Elementar zərrəciklər fizikasının əsasları [Mətn]: ali məktəb tələbələri üçün dərslik. Bakı: Nurlar. 2009. səh. 14.
- ↑ "Definition of ATOM". www.merriam-webster.com (ingilis). 2 avqust 2025. İstifadə tarixi: 9 avqust 2025.
- ↑ Pullman, Bernard. The Atom in the History of Human Thought (ingilis). Oxford University Press. 2001. ISBN 978-0-19-515040-7.
- ↑ Əliyev, Əli Binnət oğlu. Ümumi kimya: Universitet tələbələri üçün dərslik (Yenidən işlənmiş və təkmilləşdirilmiş nəşr). Bakı: Nurlan. 2005.
- ↑ Dalton, John. "A new system of chemical philosophy v. 1; pt. 2". library.si.edu. 1808. 7 sentyabr 2025 tarixində arxivləşdirilib. İstifadə tarixi: 9 avqust 2025.
- ↑ Carmen J. Giunta. Atoms In Chemistry From Dalton’s Predecessors To Complex Atoms And Beyond. 2010.
- ↑ J. J. Thomson. "Cathode rays". Philosophical Magazine. 44 (269). 1897: 293–316. 30 avqust 2019 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- 1 2 Davis, E. A. (Edward Arthur). J.J. Thomson and the discovery of the electron. London ; Bristol, PA : Taylor & Francis. 1997. ISBN 978-0-7484-0696-8.
- ↑ Thomson, J.J. "On bodies smaller than atoms". The Popular Science Monthly. avqust 1901: 323–335. 1 dekabr 2016 tarixində arxivləşdirilib. İstifadə tarixi: 21 iyun 2009.
- ↑ J. J. Thomson (1907). On the Corpuscular Theory of Matter, p. 26: "Bu nəticələrin ən sadə şərhi ondan ibarətdir ki, müsbət ionlar müxtəlif elementlərin bir və ya bir neçə korpuskulu çıxarılmış atomları və ya atom qruplarıdır, […], mənfi elektrikləşdirilmiş cisim isə elektrikləşdirilməmişdən daha artıq korpuskula malik olan cisimdir."
- ↑ Giora Hon; Bernard R. Goldstein. "J. J. Thomson's plum-pudding atomic model: The making of a scientific myth". Annalen der Physik. 525 (8–9). 6 sentyabr 2013: A129–A133. Bibcode:2013AnP...525A.129H. doi:10.1002/andp.201300732. ISSN 0003-3804. 16 iyul 2025 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ Heilbron, J. L. Ernest Rutherford: And the Explosion of Atoms (ingilis). Oxford University Press, USA. 12 iyun 2003. ISBN 978-0-19-512378-4.
- ↑ Hans Geiger; Ernest Marsden (1909). "On a Diffuse Reflection of the α-Particles". Proceedings of the Royal Society of London A. 82 (557): 495–500.
- ↑ Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64–68
- ↑ Məsimov, Eldar Əli oğlu; Mürsəlov, Tahir Məmmədrza oğlu. Atom fizikası: ali məktəblər üçün dərslik. Bakı: Çaşıoğlu. 2002.
- ↑ "What were the results of Rutherford's experiment? | Britannica" (ingilis). 7 sentyabr 2025 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ Bohr, Niels. "On the constitution of atoms and molecules" (ingilis). 10 avqust 2025 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ J. J. Thomson. "On the Charge of Electricity carried by the Ions produced by Röntgen Rays". The London, Edinburgh and Dublin Philosophical Magazine and Journal of Science. 5. 46 (283). 1898: 528–545. doi:10.1080/14786449808621229.
- ↑ Moseley, Henry G. J. . Smithsonian Libraries. "The High-Frequency Spectra of the Elements". The London, Edinburgh and Dublin Philosophical Magazine and Journal of Science. 6. London-Edinburgh: London : Taylor & Francis. 26. 1913: 1024–1034. doi:10.1080/14786441308635052.
- ↑ Moseley, Henry G. J. "The High-Frequency Spectra of the Elements. Part II". Philosophical Magazine. 6. 27. 1914: 703–713.
- ↑ Rutherford, Ernest. "Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen". Philosophical Magazine. 37 (222). 1919: 581. doi:10.1080/14786440608635919. 7 iyun 2010 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ The Development of the Theory of Atomic Structure (Rutherford 1936). Reprinted in Background to Modern Science: Ten Lectures at Cambridge arranged by the History of Science Committee 1936: "In 1919 I showed that when light atoms were bombarded by α-particles they could be broken up with the emission of a proton, or hydrogen nucleus. We therefore presumed that a proton must be one of the units of which the nuclei of other atoms were composed…"
- ↑ Orme Masson. "The Constitution of Atoms". The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science. 41 (242). 1921: 281–285. doi:10.1080/14786442108636219. Ernest Rezerfordun qeydi: "Avstraliyada bu məqaləni yazarkən professor Orm Masson "proton" adının artıq atomların nüvə quruluşuna daxil olan oksigen 16 baxımından təxminən 1 kütlə vahidi üçün uyğun ad kimi təklif olunduğunu bilmirdi. Bu bölməyə uyğun ad məsələsi bu il Britaniya Assosiasiyasının A bölməsinin bir sıra üzvlərinin Kardiffdə keçirilən qeyri-rəsmi görüşündə müzakirə olunub. Professor Massonun təklif etdiyi "baron" adı qeyd edildi, lakin mövcud məna müxtəlifliyi səbəbindən yararsız hesab edildi. Nəhayət, "proton" adı, xüsusən də Proutun bütün atomların hidrogendən ibarət olması haqqındakı məşhur fərziyyəsində verdiyi orijinal "protil" terminini təklif etdiyi üçün ümumi bəyənmə ilə qarşılandı. 1 nüvə kütlə vahidi üçün xüsusi bir ad ehtiyacı Ser Oliver Lodc tərəfindən Seksiya iclasında diqqət çəkdi və daha sonra müəllif "proton" adını təklif etdi.
- ↑ Eric Scerri (2020). The Periodic Table: Its Story and Its Significance, p. 185
- ↑ Helge Kragh (2012). Niels Bohr and the Quantum Atom, p. 33
- ↑ Cəfərov, İsgəndər Həsən oğlu. Elementar zərrəciklər fizikasının əsasları [Mətn]: ali məktəb tələbələri üçün dərslik. Bakı: Nurlar. 2009. səh. 55-56.
- ↑ McEvoy, J. P.; Zarate, Oscar. Introducing Quantum Theory. Totem Books. 2004. 110–114. ISBN 978-1-84046-577-8.
- ↑ "Matrix mechanics | physics". Britannica. 1 iyun 2025 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ Kozłowski, Miroslaw. "The Schrödinger equation A History". 2019.
- ↑ Pais, Abraham. Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. 1986. 228–230. ISBN 978-0-19-851971-3.
- ↑ Feynman, Richard; Leighton, Robert B.; Sands, Matthew. The Feynman Lectures on Physics – The Definitive Edition. 1, lecture 6. Pearson PLC, Addison Wesley. 2006. səh. 11. ISBN 978-0-8053-9046-9.
- ↑ Mccaw, Charles Stuart. Orbitals: With Applications In Atomic Spectra (ingilis). World Scientific Publishing Company. 30 mart 2015. ISBN 978-1-78326-416-2.
- ↑ Sitenko, A.; Tartakovskii, V. Theory of Nucleus: Nuclear Structure and Nuclear Interaction (ingilis). Springer Science & Business Media. 6 dekabr 2012. ISBN 978-94-011-5772-8.
- ↑ "CODATA Value: proton-electron mass ratio". physics.nist.gov. 28 mart 2019 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ "Isotope | Examples & Definition". Britannica. 24 iyul 2023 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ "Understanding the Outsized Effect of Hydrogen Isotopes". Energy.gov (ingilis). 10 avqust 2025 tarixində arxivləşdirilib. İstifadə tarixi: 10 avqust 2025.
- ↑ J. Throck Watson; O. David Sparkman. Introduction to Mass Spectrometry: Instrumentation, Applications, and Strategies for Data Interpretation. John Wiley & Sons. 4 dekabr 2007. 274–. ISBN 978-0-470-51634-8.
- ↑ "Mass Defect - an overview | ScienceDirect Topics". ScienceDirect. 11 avqust 2023 tarixində arxivləşdirilib. İstifadə tarixi: 24 avqust 2025.
- ↑ Downard K. Mass Spectrometry - A Foundation Course. Royal Society of Chemistry. 2004. doi:10.1039/9781847551306. ISBN 978-0-85404-609-6.
- ↑ Azərbaycan Sovet Ensiklopediyasının Baş Redaksiyası. Azərbaycan Sovet Ensiklopediyası - VIII Cild (P,R,S). 1984. səh. 61.
- ↑ "Goudsmit on the discovery of electron spin". www.lorentz.leidenuniv.nl. 18 iyun 2025 tarixində arxivləşdirilib. İstifadə tarixi: 16 avqust 2025.
- ↑ J. P. Hornak. "Chapter 3: Spin Physics". The Basics of NMR. Rochester Institute of Technology. 2006. 26 may 2007 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 20 mart 2011.
- ↑ Paul A. Schroeder. "Magnetic Properties". University of Georgia. 22 fevral 2000. 18 fevral 2001 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 7 yanvar 2007.
- ↑ Paul A. Schroeder. "Magnetic Properties". University of Georgia. 22 fevral 2000. 18 fevral 2001 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 7 yanvar 2007.
- ↑ Greg Goebel. "[4.3] Magnetic Properties of the Atom". Elementary Quantum Physics. In The Public Domain website. 1 sentyabr 2007. 21 avqust 2011 tarixində arxivləşdirilib. İstifadə tarixi: 7 yanvar 2007.
- ↑ Lynn Yarris. Talking Pictures. 15 iyun 1997 tarixində arxivləşdirilib. İstifadə tarixi: 9 yanvar 2008.
- ↑ Liang, Z.-P.; Haacke, E.M. Webster, J.G. (redaktor). Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. 2. John Wiley & Sons. 1999. 412–426. ISBN 978-0-471-13946-1.
- ↑ Landau, L. D.; Lifshitz, E. M. Quantum mechanics (non-relativistic theory) (PDF) (ingilis). Pergamon Press. səh. 28.
- ↑ Schombert, James. "Quantum physics" Arxiv surəti 10 may 2016 tarixindən Wayback Machine saytında University of Oregon Department of Physics
- ↑ Bohr, Niels. The theory of spectra and atomic constitution. Cambridge University Press. 1922.
- ↑ Собельман, И. И. Введение в теорию атомных спектров (PDF). Москва: Наука. 1977. 12 noyabr 2024 tarixində arxivləşdirilib (PDF). İstifadə tarixi: 24 avqust 2025.
- ↑ Jenkins, Gwilym M.; Watts, Donald G. Spectral analysis and its applications. San Francisco : Holden-Day. 1968. ISBN 978-0-8162-4464-5.
- ↑ Richards, W. G. (William Graham). Energy levels in atoms and molecules. Oxford ; New York : Oxford University Press. 1994. ISBN 978-0-19-855805-7.
- ↑ N. Ə. Əkbərov, S. N. Qəhrəmanova, Ü. Ş. Baxşıyeva və b. Məktəblinin kimya lüğəti (orta ixtisas məktəbləri üçün dərs vəsaiti), səh. 183
- ↑ Əlbəndov, Ələmdar. Ümumi kimya (PDF). Bakı: Elm. 2011.
- ↑ Кузьменко, Н.Е.; Еремин, В.В; Попков, В.А. "Начала химии. Современный курс для поступающих в вузы". 20 yanvar 2025 tarixində arxivləşdirilib. İstifadə tarixi: 16 avqust 2025.
- ↑ Тяглова, Елена Викторовна. Исследовательская деятельность учащихся по химии: метод. пособие (rus). Глобус. 2008. ISBN 978-5-903050-22-2.
- ↑ Goodstein, David L. States of Matter. Courier Dover Publications. 2002. 436–438. ISBN 978-0-13-843557-8.
- ↑ Brazhkin, Vadim V. "Metastable phases, phase transformations, and phase diagrams in physics and chemistry". Physics-Uspekhi. 49. 2006: 719–24. doi:10.1070/PU2006v049n07ABEH006013.
- ↑ Myers, Richard. The Basics of Chemistry. Greenwood Press. 2003. səh. 85. ISBN 978-0-313-31664-7. OCLC 50164580.
- ↑ Staff. "Bose-Einstein Condensate: A New Form of Matter". National Institute of Standards and Technology. 9 oktyabr 2001. 3 yanvar 2008 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 16 yanvar 2008.
- ↑ Colton, Imogen; Fyffe, Jeanette. "Super Atoms from Bose-Einstein Condensation". The University of Melbourne. 3 fevral 1999. 29 avqust 2007 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 6 fevral 2008.
- ↑ "Quantum information using Bose-Einstein condensates – NYU Quantum Technology Lab" (ingilis). 5 sentyabr 2025 tarixində arxivləşdirilib. İstifadə tarixi: 17 avqust 2025.
- ↑ Binnig G, Rohrer H. "Scanning tunneling microscopy—from birth to adolescence". Reviews of Modern Physics. 59 (3). 1 iyul 1987: 615–625. Bibcode:1987RvMP...59..615B. doi:10.1103/RevModPhys.59.615.
- ↑ Chen CJ. Introduction to Scanning Tunneling Microscopy (PDF). Oxford University Press. 1993. ISBN 978-0-19-507150-4. 18 dekabr 2022 tarixində arxivləşdirilib (PDF).
- ↑ Bai C. Scanning tunneling microscopy and its applications. New York: Springer Verlag. 2000. ISBN 978-3-540-65715-6.
- ↑ "WMAP Cosmology 101: Matter in the Universe". map.gsfc.nasa.gov. 16 avqust 2025 tarixində arxivləşdirilib. İstifadə tarixi: 16 avqust 2025.
- ↑ Choppin, Gregory R.; Liljenzin, Jan-Olov; Rydberg, Jan. Radiochemistry and Nuclear Chemistry. Elsevier. 2001. səh. 441. ISBN 978-0-7506-7463-8. OCLC 162592180.
- ↑ Davidsen, Arthur F. "Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission". Science. 259 (5093). 1993: 327–34. doi:10.1126/science.259.5093.327. PMID 17832344. 11 yanvar 2008 tarixində arxivləşdirilib. İstifadə tarixi: 7 yanvar 2008.
- ↑ Lequeux (2005:4).
- ↑ Smith, Nigel. "The search for dark matter". Physics World. 6 yanvar 2000. 16 fevral 2008 tarixində arxivləşdirilib. İstifadə tarixi: 14 fevral 2008.
- ↑ "Elementler ve Atomlar Evrende Nasıl Oluştu? » Kozan Demircan" (türk). 27 yanvar 2021. 22 may 2024 tarixində arxivləşdirilib. İstifadə tarixi: 16 avqust 2025.
- ↑ Abbott, Brian. "Microwave (WMAP) All-Sky Survey | Guide | Digital Universe | Hayden Planetarium" (ingilis). 13 fevral 2013 tarixində arxivləşdirilib. İstifadə tarixi: 16 avqust 2025.
- ↑ Hoyle, F. "The synthesis of the elements from hydrogen". Monthly Notices of the Royal Astronomical Society. 106 (5). 1946: 343–383. Bibcode:1946MNRAS.106..343H. doi:10.1093/mnras/106.5.343.
- ↑ Knauth, D.C.; Knauth, D.C.; Lambert, David L.; Crane, P. "Newly synthesized lithium in the interstellar medium". Nature. 405 (6787). 2000: 656–658. Bibcode:2000Natur.405..656K. doi:10.1038/35015028. PMID 10864316.
- ↑ "GeoKansas--Geotopics--Age of the Earth". Kansas Geological Survey. 5 iyul 2008 tarixində arxivləşdirilib. İstifadə tarixi: 17 avqust 2025.
- ↑ Manuel (2001). Origin of Elements in the Solar System, pp. 40–430, 511–519
- ↑ Dalrymple, G. Brent. "The age of the Earth in the twentieth century: a problem (mostly) solved". Special Publications, Geological Society of London. 190 (1). 2001: 205–221. Bibcode:2001GSLSP.190..205D. doi:10.1144/GSL.SP.2001.190.01.14.
- ↑ Anderson, Don L.; Foulger, G. R.; Meibom, Anders. "Helium: Fundamental models". MantlePlumes.org. 2 sentyabr 2006. 8 fevral 2007 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2007.
- ↑ Pennicott, Katie. "Carbon clock could show the wrong time". PhysicsWeb. 10 may 2001. 15 dekabr 2007 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ Yarris, Lynn. "New Superheavy Elements 118 and 116 Discovered at Berkeley Lab". Berkeley Lab. 27 iyul 2001. 9 yanvar 2008 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ Diamond, H.; və b. "Heavy Isotope Abundances in Mike Thermonuclear Device" (subscription required). Physical Review. 119. 1960: 2000–04. doi:10.1103/PhysRev.119.2000. 12 noyabr 2011 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ Poston Sr., John W. "Do transuranic elements such as plutonium ever occur naturally?". Scientific American. 23 mart 1998. 1 oktyabr 2008 tarixində arxivləşdirilib. İstifadə tarixi: 15 yanvar 2008.
- ↑ Keller, C. "Natural occurrence of lanthanides, actinides, and superheavy elements". Chemiker Zeitung. 97 (10). 1973: 522–30. 1 oktyabr 2008 tarixində arxivləşdirilib. İstifadə tarixi: 15 yanvar 2008.
- ↑ Marco (2001:17).
- ↑ Manuel (2001:407–430,511–519).
- ↑ "Oklo Fossil Reactors". Curtin University of Technology. 18 dekabr 2007 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 15 yanvar 2008.
- ↑ Weisenberger, Drew. "How many atoms are there in the world?". Jefferson Lab. 22 oktyabr 2007 tarixində arxivləşdirilib. İstifadə tarixi: 16 yanvar 2008.
- ↑ Pidwirny, Michael. "Fundamentals of Physical Geography". University of British Columbia Okanagan. 21 yanvar 2008 tarixində arxivləşdirilib. İstifadə tarixi: 16 yanvar 2008.
- ↑ Anderson, Don L. "The inner inner core of Earth". Proceedings of the National Academy of Sciences. 99 (22). 2002: 13966–68. doi:10.1073/pnas.232565899. PMID 12391308. 1 avqust 2013 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 16 yanvar 2008.
- ↑ Karpov, A. V.; Zagrebaev, V. I.; Palenzuela, Y. M.; və b. "Decay properties and stability of the heaviest elements" (PDF). International Journal of Modern Physics E. 21 (2). 2012: 1250013–1–1250013–20. Bibcode:2012IJMPE..2150013K. doi:10.1142/S0218301312500139. 3 dekabr 2016 tarixində arxivləşdirilib (PDF). İstifadə tarixi: 24 avqust 2025.
- ↑ Anonymous. "Second postcard from the island of stability". CERN Courier. 2 oktyabr 2001. 3 fevral 2008 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ "Superheavy Element 114 Confirmed: A Stepping Stone to the Island of Stability". Berkeley Lab. 2009. 20 iyul 2019 tarixində arxivləşdirilib. İstifadə tarixi: 23 oktyabr 2019.
- ↑ Möller, P. "The limits of the nuclear chart set by fission and alpha decay" (PDF). EPJ Web of Conferences. 131. 2016: 03002–1–03002–8. Bibcode:2016EPJWC.13103002M. doi:10.1051/epjconf/201613103002. 11 mart 2020 tarixində arxivləşdirilib (PDF). İstifadə tarixi: 24 avqust 2025.
- ↑ Koppes, Steve. "Fermilab Physicists Find New Matter-Antimatter Asymmetry". University of Chicago. 1 mart 1999. 19 iyul 2008 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ Cromie, William J. "A lifetime of trillionths of a second: Scientists explore antimatter". Harvard University Gazette. 16 avqust 2001. 3 sentyabr 2006 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ Hijmans, Tom W. "Particle physics: Cold antihydrogen". Nature. 419. 2002: 439–40. doi:10.1038/419439a.
- ↑ Staff. "Researchers 'look inside' antimatter". BBC News. 30 oktyabr 2002. 22 fevral 2007 tarixində arxivləşdirilib. İstifadə tarixi: 14 yanvar 2008.
- ↑ Barrett, Roger; Jackson, Daphne; Mweene, Habatwa. "The Strange World of the Exotic Atom". New Scientist (1728). 1990: 77–115. 21 dekabr 2007 tarixində orijinalından arxivləşdirilib. İstifadə tarixi: 4 yanvar 2008.
- ↑ Indelicato, Paul. "Exotic Atoms". Physica Scripta. T112. 2004: 20–26. doi:10.1238/Physica.Topical.112a00020.
- ↑ Ripin, Barrett H. "Recent Experiments on Exotic Atoms". American Physical Society. 1998. 23 iyul 2012 tarixində arxivləşdirilib. İstifadə tarixi: 15 fevral 2008.


