Stexiometriya (yun. stoicheion əsası, element və metrik) — kimyanın reaksiyaya girən maddələrin kəmiyyət nisbətləri qanunları, kimyəvi düsturların və kimyəvi reaksiyaların tənliklərinin alınması ilə məşğul olan bölməsidir. Avoqadro qanunu, Gey-Lussak qanunları, tərkibin sabitliyi qanunu, kütlənin saxlanması qanunu və qatlı nisbətlər qanunu stoxiometriyanın əsasını təşkil edir. Stexiometrik hesablamalar kimya texnologiyasında və metallurgiyada geniş istifadə olunur.
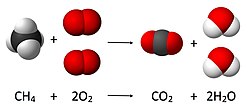
Reagentin stexiometrik miqdarı və ya stexiometrik nisbəti optimal miqdar və ya nisbətdir, burada reaksiyanın tamamlandığını fərz etsək:
Bütün reagentin istehlak edildiyi Reagentin çatışmazlığı olmadığı Reagentin artıqlığı olmadığı. Stoxiometriya onu daha yaxşı başa düşməyə kömək edən qanunlara, yəni kütlənin qorunması qanununa, müəyyən nisbətlər qanununa (yəni sabit tərkib qanununa), çoxlu nisbətlər qanununa və qarşılıqlı nisbətlər qanununa əsaslanır. Ümumiyyətlə, kimyəvi reaksiyalar kimyəvi maddələrin müəyyən nisbətlərində birləşir. Kimyəvi reaksiyalar nə maddə yarada, nə məhv edə, nə də bir elementi digərinə çevirə bilmədiyi üçün hər bir elementin miqdarı ümumi reaksiya boyunca eyni olmalıdır. Məsələn, reaktiv tərəfdəki verilmiş X elementinin atomlarının sayı, bütün bu atomların bir reaksiyada iştirak edib-etməməsindən asılı olmayaraq, məhsul tərəfindəki həmin elementin atomlarının sayına bərabər olmalıdır.
Kimyəvi reaksiyalar, makroskopik vahid əməliyyatları kimi, bir çox elementar reaksiyalardan ibarətdir, burada tək bir molekul başqa bir molekulla reaksiyaya girir. Reaksiyaya girən molekullar (və ya düstur vahidləri və ya ion cütləri) tam ədəd nisbətində müəyyən bir atom dəstindən ibarət olduğundan, tam reaksiyada reaktivlər arasındakı nisbət də tam ədəd nisbətindədir. Bir reaksiya birdən çox molekul istehlak edə bilər və stexiometrik ədəd bu ədədi sayır, məhsullar üçün müsbət (əlavə edilmiş) və reaktivlər üçün mənfi (çıxarılmış) olaraq təyin olunur. İşarəsiz əmsallar ümumiyyətlə stexiometrik əmsallar adlanır.
Hər bir elementin atom kütləsi var (adətən standart atom çəkisi şəklində orta qiymət kimi verilir) və molekulları atomlar toplusu kimi nəzərə alsaq, hər bir birləşmənin molekulyar kütləsi (molekulyardırsa) və ya düstur kütləsi (molekulyar deyilsə) var, bu da daltonlarla ifadə edildikdə ədədi olaraq q/mol ilə ifadə edilən molar kütləyə bərabərdir. Tərifinə görə, karbon-12-nin atom kütləsi tam olaraq 12 Da-dır, bu da onun molar kütləsini 12 q/mol edir. Bir maddədəki mol başına düşən kimyəvi maddələrin sayı, SI-nin 2019-cu il düzəlişindən bəri dəqiq olaraq 6.02214076×1023 mol−1 olan Avoqadro sabiti ilə verilir. Beləliklə, stexiometriyanı kütlə ilə hesablamaq üçün hər bir reaktiv üçün tələb olunan molekulların sayı mollarla ifadə edilir və hər bir reaktivin reaksiyanın mol başına düşən kütləsini almaq üçün hər birinin molar kütləsinə vurulur. Kütlə nisbətləri hər birini bütün reaksiyadakı cəminə bölməklə hesablana bilər.
Təbii vəziyyətdə olan elementlər müxtəlif kütləli izotopların qarışığıdır; beləliklə, atom kütlələri və beləliklə, molar kütlələr tam ədədlər deyil. Məsələn, dəqiq 14:3 nisbəti əvəzinə, 17.031 q ammonyak 14.007 q azot və 3 × 1.008 q hidrogendən ibarətdir, çünki təbii azot az miqdarda azot-15, təbii hidrogen isə hidrogen-2 (deuterium) ehtiva edir.
Stexiometrik reaktiv, bir mərhələdə reaksiyaya girib digər mərhələdə bərpa olunduğu üçün ümumi reaksiyada istehlak olunmayan katalitik reaktivdən fərqli olaraq, reaksiyada istehlak olunan reaktivdir.
"Stexiometriya" termini ilk dəfə 1792-ci ildə Jeremias Benjamin Rixter tərəfindən Rixterin "Anfangsgründe der Stöchyometrie oder Meßkunst chymischer Elemente" ("Stexiometriyanın əsasları" və ya "Kimyəvi Elementlərin Ölçülməsi Sənəti") əsərinin birinci cildi nəşr olunanda istifadə edilmişdir. Bu termin qədim yunanca στοιχεῖον stoikheîon "element" və μέτρον métron "ölçmə" sözlərindən əmələ gəlmişdir. Lüdviq Darmştedter və Ralf E. Oesper bu barədə faydalı bir hesabat yazmışlar.
Bu məqalə qaralama halındadır. Məqaləni edərək Vikipediyanı zənginləşdirə bilərsiniz. |