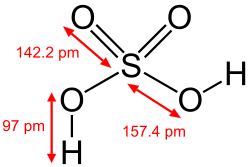
Sulfat turşusu, H2SO4 — qüvvətli ikiəsaslı turşu.
| Sulfat turşusu | |
|---|---|
 | |
 | |
 | |
| Ümumi | |
| Sistematik adı | Sulfat turşusu |
| Kimyəvi formulu | H2SO4 |
| Fiziki xassələri | |
| Nisbi mol. kütl. | 98,082 а. k. v. |
| Molyar kütlə | 980,826 q/mol |
| Aqreqat halı | maye |
| Sıxlıq | 183,564 q/sm³ |
| Dinamik özüllülük | 21 mPa·s[1] |
| Termik xüsusiyyətlər | |
| Ərimə nöqtəsi | 10,384 °C |
| Qaynama nöqtəsi | 279,6 °C |
| Xüsusi ərimə istiliyi | 10,73 C/kq |
| Buxarın təzyiqi | 0,001 ± 0,001 mm Hg[2] |
| Kimyəvi xassələri | |
| Turşunun dissosasiya sabiti | -3 |
| Suda həllolma | qarışır q/100 ml |
| Optik xüsusiyyətlər | |
| Sındırma əmsalı | 1.397 |
| Təsnifatı | |
| CAS-da qeyd. nöm. | 7664-93-9 |
| PubChem | 1118, 22066174, 5152822 |
| EINECS-də qeyd. nöm. | 231-639-5 |
| SMILES | |
| InChI | |
| E nömrəsi | 231-639-5 |
| RTECS | WS5600000 |
| ChEBI | 26836 |
| BMT nömrəsi | 1830 |
| ChemSpider | 1086 |
| Toksikologiya | |
| LD50 | 510 mq/kq |
| Zəhərliliyi | |
| Məlumatlar normal şərait (25 °C, 100 kPa) üçün verilmişdir. | |
Susuz sulfat turşusu adi şəraitdə rəngsiz, iysiz, yağabənzər ağır mayedir, sıxlığı 1,9203 q/sm3-dir, 10,45°S-də donur, 296,2°S-də qaynayır. Su ilə istənilən nisbətlərdə qarışır. Qatı sulfat turşusu demək olar ki, bütün metallarla reaksiyaya girib, müvafiq duz (sulfat) əmələ gətirir, hidrogen-yodidi, qismən də hidrogen-bromidi oksidləşdirib, sərbəst halogenə çevirir, qızdırıldıqda bütün metalları (qızıl və platin müstəsna olmaqla) oksidləşdirir. Durulaşdırılmış sulfat turşusu gərginlik sırasında hidrogendən solda yerləşən bütün metallarla (qurğuşundan başqa) reaksiyaya girir.
Sulfat turşusu almaq üçün əsas xammal, təbii sulfidlərin (pirit, kolçedan) yandırılmasında əmələ gələn kükürd qazıdır (SO2). Bu qazı kontakt və ya qüllə üsulu ilə sulfat anhidridinə SO3 çevirərək suda həll etməklə sulfat turşusu alırlar.
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
- 2So2 + O2 → 2SO3 + Q
- SO3(q) + H2O(m) → H2SO4 +Q
Sulfat turşusu kimya sənayesinin əsas məhsullarından biridir. Ondan mineral gübrə (super-fosfat, ammonium-sulfat), müxtəlif turşu, duz, darman, yuyucu maddə, boya, süni lif, partlayıcı maddə və s. istehsalında geniş istifadə edilir.
Sulfat turşusu metallurgiyada (məsələn, uran filizini parçalamaq üçün), neft məhsullarının təmizlənməsində və s. məqsədlə, həmçinin quruducu maddə kimi işlədilir. Dünyada hər il 100 mln. tona yaxın sulfat turşusu istehsal olunur.

